Solve
Guides
0
You visited us 0 times! Enjoying our articles? Unlock Full Access!Question
1 Calculate the electrode potentials of the following
half cell at 25°C,
(i) Pt, Cl2 (10 atm) | HCI (0.1 M)
(ii) Pt, H2 (5 atm) | HCI (0.5 M)
Given: Eºlc/c = +1.36 V and Ext, 1H= 0.00 V.

Open in App
Solution
Verified by Toppr
Was this answer helpful?
2
Similar Questions
Q1
Paragraph for below question
There are two types of concentration cells.
(i) Electrode concentration Cell: In this type of cell electrode has different concentration of electrode material in the same electrolyte.
Ex. Pt|H2(P1 atm)|HCl(cM)|H2(P2 atm)|Pt
(ii) Electrolyte Concentration Cell: In this type of cell, same electrode is immersed in the electrolyte having common species but different concentrations.
Ex. Pt|H2(1 atm)|HCl(c1M)||HCl(c2M)|H2 (1 atm)|Pt
Q. EMF of the following electrochemical cell Pt|H2(1 atm)|HA(0.1 M)||HCl(0.1 M)|H2(1 atm)|Pt is 0.18 V at 25°C. Then calculate Ka of weak acid HA. (UseRT×2.303F=0.06]
नीचे दिए गए प्रश्न के लिए अनुच्छेद
सांद्रता सेल दो प्रकार के होते हैं :
(i) इलेक्ट्रॉड सांद्रता सेल: इस प्रकार के सेल में, एक ही विद्युतअपघटय में स्थित इलेक्ट्रॉडों के पदार्थ की सांद्रता भिन्न होती है।
उदाहरण : Pt|H2(P1 atm)| HCl(cM)|H2(P2 atm)|Pt
(ii) विद्युतअपघट्य सांद्रता सेल: इस प्रकार के सेल में समान इलेक्ट्रॉड, समान स्पीशीज लेकिन भिन्न सांद्रताओं वाले विद्युत अपघट्य में डूबे रहते हैं।
उदाहरण : Pt|H2(1 atm)|HCl(c1M)|| HCl(c2M)|H2 (1 atm)| Pt
प्रश्न. 25°C पर विद्युत रासायनिक सेल Pt|H2(1 atm)|HA(0.1 M)||HCl(0.1 M)|H2(1 atm)|Pt का वि.वा.ब. (EMF) 0.18 V है। तब दुर्बल अम्ल HA के Ka की गणना कीजिए।
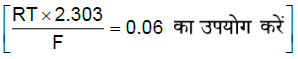
There are two types of concentration cells.
(i) Electrode concentration Cell: In this type of cell electrode has different concentration of electrode material in the same electrolyte.
Ex. Pt|H2(P1 atm)|HCl(cM)|H2(P2 atm)|Pt
(ii) Electrolyte Concentration Cell: In this type of cell, same electrode is immersed in the electrolyte having common species but different concentrations.
Ex. Pt|H2(1 atm)|HCl(c1M)||HCl(c2M)|H2 (1 atm)|Pt
Q. EMF of the following electrochemical cell Pt|H2(1 atm)|HA(0.1 M)||HCl(0.1 M)|H2(1 atm)|Pt is 0.18 V at 25°C. Then calculate Ka of weak acid HA. (UseRT×2.303F=0.06]
नीचे दिए गए प्रश्न के लिए अनुच्छेद
सांद्रता सेल दो प्रकार के होते हैं :
(i) इलेक्ट्रॉड सांद्रता सेल: इस प्रकार के सेल में, एक ही विद्युतअपघटय में स्थित इलेक्ट्रॉडों के पदार्थ की सांद्रता भिन्न होती है।
उदाहरण : Pt|H2(P1 atm)| HCl(cM)|H2(P2 atm)|Pt
(ii) विद्युतअपघट्य सांद्रता सेल: इस प्रकार के सेल में समान इलेक्ट्रॉड, समान स्पीशीज लेकिन भिन्न सांद्रताओं वाले विद्युत अपघट्य में डूबे रहते हैं।
उदाहरण : Pt|H2(1 atm)|HCl(c1M)|| HCl(c2M)|H2 (1 atm)| Pt
प्रश्न. 25°C पर विद्युत रासायनिक सेल Pt|H2(1 atm)|HA(0.1 M)||HCl(0.1 M)|H2(1 atm)|Pt का वि.वा.ब. (EMF) 0.18 V है। तब दुर्बल अम्ल HA के Ka की गणना कीजिए।
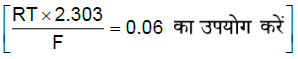
View Solution
Q2
Paragraph for below question
There are two types of concentration cells.
(i) Electrode concentration Cell: In this type of cell electrode has different concentration of electrode material in the same electrolyte.
Ex. Pt|H2(P1 atm)|HCl(cM)|H2(P2 atm)|Pt
(ii) Electrolyte Concentration Cell: In this type of cell, same electrode is immersed in the electrolyte having common species but different concentrations.
Ex. Pt|H2(1 atm)|HCl(c1M)||HCl(c2M)|H2 (1 atm)|Pt
Q. Calculate emf of the following concentration cell at 25°C.
Pt|H2(1 atm)|HCl(10–5 M)||CH3COOH(0.1 M)|H2(1 atm)|Pt
[Given: Ka (CH3COOH) = 10–5. Use 2.3030RTF=0.06]
नीचे दिए गए प्रश्न के लिए अनुच्छेद
सांद्रता सेल दो प्रकार के होते हैं :
(i) इलेक्ट्रॉड सांद्रता सेल: इस प्रकार के सेल में, एक ही विद्युतअपघटय में स्थित इलेक्ट्रॉडों के पदार्थ की सांद्रता भिन्न होती है।
उदाहरण : Pt|H2(P1 atm)| HCl(cM)|H2(P2 atm)|Pt
(ii) विद्युतअपघट्य सांद्रता सेल: इस प्रकार के सेल में समान इलेक्ट्रॉड, समान स्पीशीज लेकिन भिन्न सांद्रताओं वाले विद्युत अपघट्य में डूबे रहते हैं।
उदाहरण : Pt|H2(1 atm)|HCl(c1M)|| HCl(c2M)|H2 (1 atm)| Pt
प्रश्न. 25°C पर निम्नलिखित सांद्रता सेल के वि.वा.ब. (emf) की गणना कीजिए
Pt|H2(1 atm)|HCl(10–5 M)||CH3COOH(0.1 M)|H2(1 atm)|Pt
[दिया गया है: Ka(CH3COOH) = 10–5, प्रयोग करें : 2.3030RTF=0.06]
There are two types of concentration cells.
(i) Electrode concentration Cell: In this type of cell electrode has different concentration of electrode material in the same electrolyte.
Ex. Pt|H2(P1 atm)|HCl(cM)|H2(P2 atm)|Pt
(ii) Electrolyte Concentration Cell: In this type of cell, same electrode is immersed in the electrolyte having common species but different concentrations.
Ex. Pt|H2(1 atm)|HCl(c1M)||HCl(c2M)|H2 (1 atm)|Pt
Q. Calculate emf of the following concentration cell at 25°C.
Pt|H2(1 atm)|HCl(10–5 M)||CH3COOH(0.1 M)|H2(1 atm)|Pt
[Given: Ka (CH3COOH) = 10–5. Use 2.3030RTF=0.06]
नीचे दिए गए प्रश्न के लिए अनुच्छेद
सांद्रता सेल दो प्रकार के होते हैं :
(i) इलेक्ट्रॉड सांद्रता सेल: इस प्रकार के सेल में, एक ही विद्युतअपघटय में स्थित इलेक्ट्रॉडों के पदार्थ की सांद्रता भिन्न होती है।
उदाहरण : Pt|H2(P1 atm)| HCl(cM)|H2(P2 atm)|Pt
(ii) विद्युतअपघट्य सांद्रता सेल: इस प्रकार के सेल में समान इलेक्ट्रॉड, समान स्पीशीज लेकिन भिन्न सांद्रताओं वाले विद्युत अपघट्य में डूबे रहते हैं।
उदाहरण : Pt|H2(1 atm)|HCl(c1M)|| HCl(c2M)|H2 (1 atm)| Pt
प्रश्न. 25°C पर निम्नलिखित सांद्रता सेल के वि.वा.ब. (emf) की गणना कीजिए
Pt|H2(1 atm)|HCl(10–5 M)||CH3COOH(0.1 M)|H2(1 atm)|Pt
[दिया गया है: Ka(CH3COOH) = 10–5, प्रयोग करें : 2.3030RTF=0.06]
View Solution
Q3
Calculate the electrode potential for $$\underset{(1 atm)}{(Pt)|H_2}|H^+(c=0.1 M)$$.
View Solution
Q4
Write the cell reaction and calculate the emf of the cell
$$Pt |H_2 (g, 1 atm) | H^+ (0.5 M) || KCl (1 M) |Hg_2Cl_2 (s) | Hg (l) | Pt$$ at $$25^o C, \, E_{} = 0.28 V$$
$$Pt |H_2 (g, 1 atm) | H^+ (0.5 M) || KCl (1 M) |Hg_2Cl_2 (s) | Hg (l) | Pt$$ at $$25^o C, \, E_{} = 0.28 V$$
View Solution
Q5
Write balanced equations for the half reactions and calculate the reduction potentials at 250C for the following half cells :
Cl−(1.2M)|Cl2(g,3.6atm)|PtEo=1.36V
Cl−(1.2M)|Cl2(g,3.6atm)|PtEo=1.36V
View Solution


